ESTRUCTURA Y FUNCIÓN DEL FACTOR DE NECROSIS TUMORAL |
||
|
|
||
|
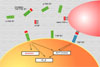
El factor de necrosis tumoral fue descubierto casualmente por William Coley (1893) que observó que en los pacientes con cáncer que desarrollaban un infección bacteriana se inducía una necrosis tumoral. En la esperanza de curar el cáncer, Coley trató a pacientes con cáncer con el sobranadante de algunos cultivos bacterianos. Las inyecciones de este sobrenadante, (llamadas toxinas de Coley) mostraron una cierta actividad en la necrosis tumoral, pero tenían efectos secundarios muy graves. Hubo que esperar hasta 1975 cuando se demostró que el sobrenadante de Coley tenía en realidad unas endotoxinas bacterianas que estimulaban a las células del sistema inmunológico a que secretaran una sustancia que, ella sí, tenía un efecto antitumoral siendo bautizada por este motivo como factor de necrosis tumoral. Unos años más tarde, se descubrió que el TNF estaba formado por dos productos diferentes, el TNF-a que era idéntico a la catecquina (una sustancia que se produce en algunas enfermedades como la coagulación intravascular diseminada) y el TNF-b indéntico a la linfotoxina humana. Ambas formas del TNF tienen funciones similares. El TNF-a es producido sobre todo por los macrófagos y ejerce sus efectos sobre las células tumorales e inflamatorias. El TNF-b es excretado por algunas células T en particular por las células T citotóxicas y las células colaboradoras (Helpers) y también ataca células tumorales en las que induce efectos citotóxicos. El TNF-a. pertenece a la familia de las citokinas que estimulan las reacciones agudas. Es un glicoproteína de 185 aminoácidos procedentes de un precursor de 212 aminoácidos que se hidroliza mediante la denominada TACE (enzima de conversión del TNF-a). Los monocitos expresan varias isoformas del TNF-a con pesos moleculares que oscilan entre 21.5-28 kDa, isoformas que difieren en equeñas alteraciones post-translacionales de la glicosilación y fosforilización. El gen que codifica el TNF se encuentra en el locus 7p21-p14 y tiene una longitud de 5 kb. El TNF-a se presenta en forma de trímeros que pueden estar unidos a membranas celulares (se habla entonces de mem-TNF-a) o en solución (s-TNF-a) (*) El TNF-a es producido por numerosas células, influyen los monocitos, fibroblastos y células epiteliales. Otras células que lo producen al ser estimuladas son los macrófagos, células T y linfocitos V, granulocitos, células musculares lisas y queratinocitos. Las células del glioblastoma producen grandes cantidades de TNF-a. Son estímulos fisiológicos para la secreción de TNF-a las endotoxinas bacterianas, la interleukina IL-1, el factor de crecimiento derivado de las plaquetas PDGF y la oncostatina M. En los fibroblastos, la producción del TNF-a es inducida por el factor de crecimiento neuronal, y en las células endoteliales, epiteliales y fibrosblásticas por la IL-17. Se conocen dos receptores para el factor de necrosis tumoral denominados TNF-R1 (o CD120a) y TNF-R2 o (CD129b) de 55 y 75 Kdaltons, respectivamente. El TNF-1 es una proteína glicosilada de 455 aminoácidos de los cuales 171 se encuentran en la porción extracelular. Es receptor está estructuralmente relacionado con el NGF (factor de crecimiento neuronal) y con el antígeno humano CD-40. La porción intracelular del TNF-R1 contiene el llamado "dominio" de muerte que está implicado en los procesos que llevan a la muerte celular programada. El receptor TNF-R1 se une preferentemente al TNF soluble y posee un dominio de muerte que regula la apoptosis. Por el contrario, el TNF-R2 tiene una mayor afinidad hacia el mem-TNF, careciendo de dominio de muerte. Sin embargo, el TNF-R2 también puede iniciar la muerte celular estimulando el TNF-R1. Los dos receptores puede activar las vías de transducción de señales del factor nuclear kappa B o de las kinasas activadas por proteínas mitogénicas. Estas opciones de múltiples señales permiten al TNF el promover una gran variedad de respuestas celulares, como la apostosis en la proliferación celular, o la movilización de los leucocitos. Los receptores para el factor de necrosis tumoral se encuentran en las células mononucleares, la membrana sinovial, la sangre periférica y el líquido sinovial. También existen receptores libres en solución que han sido excretados por los mononucleares. En algunas enfermedades como la artritis reumatoide, el lupus sistemico eritematoso, la esclerosis múltiple y en algunas formas de osteoartritis los receptores al TNF solubles son más abundantes de lo normal. Este mayor número de receptores "captura" un cierto número de moléculas de TNF, quedando menos de estas para activar las células mononucleares. En cierto modo, los receptores solubles al TNF actúan como inhibidores naturales. Existe una relación entre los niveles de receptores solubles y la intensidad de la enfermedad. Estos hallazgos han llevado a los científicos de la industria farmaceútica a desarrollar fármacos que antagonizan o inhiben el TNF-a. tales como el infliximab o adalimumab, dos anticuerpos monoclonales dirigidos contra el TNF-a o el etanercept, una proteína de fusión que actúa como ligando del TNF-a.. Todos estos fármacos han mostrado su utilidad en el tratamiento de la artritis reumatoide, la enfermedad de Crohn, la psoriasis en placas y otras enfermedades caracterizas por una mayor expresión del TNF |
|
REFERENCIAS
|
||
| Monografía creada el 15 de Noviembre de 2014 | ||