ENFERMEDADES POR DEFICIENCIA O TRASTORNOS DEL METABOLISMO DEL COBRE |
|
El cobre (Cu) es un oligoelemento esencial para numerosos procesos biológicos, siendo un cofactor o grupo prostético de numerosas enzimas y un elemento que influye sobre la expresión de muchos genes. Las concentraciones de cobre son mayores en el hígado, cerebro, corazón y riñones. Aunque el músculo muestra concentraciones de cobre poco elevadas, al constituir una masa importante representa el 40% del cobre presente en el organismo. El cobre
se encuentra ampliamente distribuído en los alimentos, en especial
en los productos de origen animal excepto la leche, de manera que es
fácil cubrir las necesidades diarias de 0.7 a 3 mg. Los alimentos
más ricos en cobre son las ostras, las vísceras animales
(hígado, riñones, etc), el chocolate, los frutos secos
y la carne (*).
El departamento de Agricultura de los EE.UU estima que las necesidades
diarias de cobre son de 1.5 a 3 mg para los adultos y adolescentes y
de 0.7 a 2 mg para los niños. |
|
|
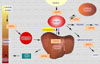
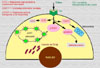
La absorción del cobre en la dieta depende de un cierto número de factores tales como el contenido en fibras de la dieta, los fitatos, las secreciones que secuestran el cobre y el cinc. La absorción del cobre tiene lugar en el intestino delgado, entrando en la superficie mucosa de las células por difusión facilitada. En el interior de las células intestinales capaces de absorber el cobre, los iones Cu+2 se encuentran unidos a la metalotioneína frente a la que muestran una mayor afinidad que el cinc. Se cree que la cantidad de cobre que se absorbe depende de la cantidad de metalotioneína en las células mucosas. En total, se absorbe entre el 25% y el 60% del cobre aportado. El 90% del cobre absorbido es incorpora a la ceruloplasmina plasmática. El resto se une a la albúmina, transcupreína y otras proteínas plasmáticas (*) El cobre es transportado al hígado a través de la vena porta. En los hepatocitos, el cobre es captado por las metalotioneínas para su almacenamiento o se incopora a varias cuproenzimas. Las metalotioneinas cargadas de cobre son almacenadas en los lisosomas de los hepatocitos, evitando de esta manera la toxicidad propia del metal libre ionizado. Cuando es necesitado, el cobre es de nuevo incorporado a la ceruloplasmina y excretado al plasma. El transporte del cobre en todos estos procesos se realiza gracias a unas proteínas especializadas denominadas chaperonas cúpricas (*) y por varias ATP-asas cuprodependientes o proteínas de Menkes. El cobre en exceso es eliminado por vía biliar y excretado en las heces. Durante el embarazo aumentan las concentraciones plasmáticas de ceruloplasmina, así como con el uso de anticonceptivos orales. También se observan concentraciones de cobre elevadas en los pacientes con infecciones agudas o crónicas, enfermedades hepáticas y la pelagra. Además, cualquier enfermedad que interfiera con la eliminación biliar puede ocasionar un aumento de las concentraciones hepáticas de cobre. Enzimas dependientes del cobre El cobre es un componente de muchas enzimas, atribuyéndose muchas de las manifestaciones clínicas de la deficiencia de cobre al fallo de estas enzimas. El cobre en la ceruloplasmina juega un papel importante en la oxidación del hierro antes de que este sea transportado al plasma. La lisil-oxidasa, una enzima que contiene cobre, es esencial para las reacciones de entrecruzamiento del colágeno y de la elastina. También participa en la superóxido dismutasa y en otras enzimas en las que su papel no es todavía bien conocido. Otras enzimas importantes en las que se encuentra presente el cobre son la dopamina b-monooxigenasa, una enzima implicada en la síntesis de las catecolaminas y en la peptidil-a-amida-monooxigenasa que modifica los neurotransmisores peptídicos. Deficiencia de cobre La deficiencia
de cobre se caracteriza por anemia, neutropenia y anormalidades esqueléticas,
especialmente la desmineralización. Otras alteraciones que siguen
son hemorragías subperiósteas, despigmentación
de la piel y de los cabellos y formación defectuosa de la elastina.
En los niños con deficiencia de cobre, el síntoma más
relevante es la anemia. La deficiencia en cobre se diagnostica determinando
los niveles plasmáticos de este elemento, los niveles de ceruloplasmina,
superoxido dismutasa o mejor aún de citocromo C oxidasa. |
|
 |
Enfermedades por deficiencia de cobre o por alteraciones de su metabolismo
|
|
|
||
REFERENCIAS
|
||
|
||
|
||
Monografía revisada el 4 de Mayo de 2011. Equipo de Redacción de IQB. |
||
|
|